新型コロナウイルスの構造と細胞内動態の制御に基づく新規薬剤の開発

- 研究代表者
- Richard Wong
- 所属・役職
- ナノ生命科学研究所 教授
- 研究分野
- 分子細胞生物学
- プロジェクトメンバー
- Richard Wong(ナノ生命科学研究所、新学術創成研究機構 教授)
福間 剛士 (ナノ生命科学研究所 教授)
安藤 敏夫 (ナノ生命科学研究所 特任教授)
羽澤 勝治 (新学術創成研究機構 助教)
Lim Kee Siang (ナノ生命科学研究所 特任助教)
小林 亜紀子 (新学術創成研究機構 特任助教)
研究の概要
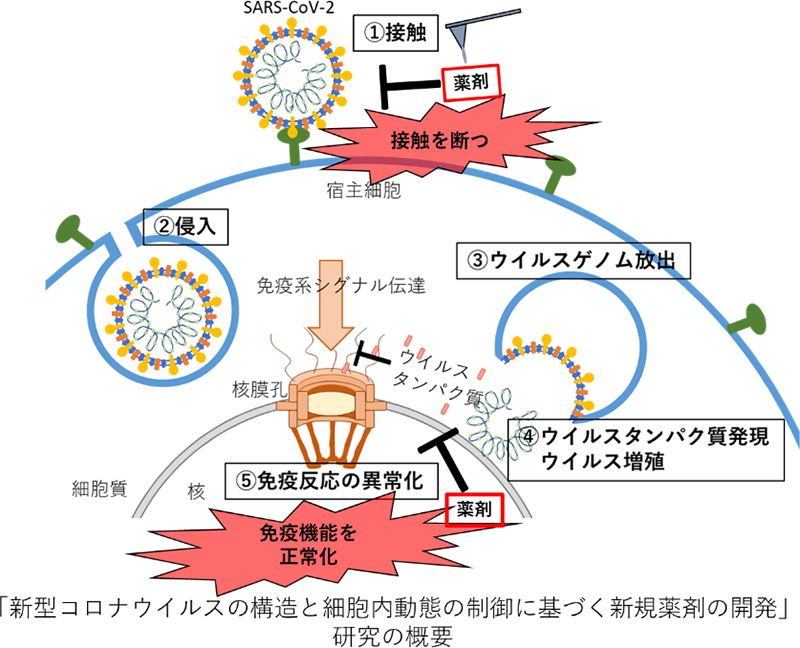
本研究は、新型コロナウイルスSARS-CoV-2を宿主細胞へ接触させない薬剤、さらにSARS-CoV-2が引き起こす宿主細胞の免疫異常化を阻止する薬剤の開発を目的としています。
SARS-CoV-2は驚異的な感染力を備え、重篤な肺炎を起こすウイルスであり、その感染症COVID-19により全世界で90万人近くが死亡しています(2020年9月現在)。現在、世界中で感染予防のためのワクチンや治療薬の開発を目的とし、SARS-CoV-2 の感染・重症化 メカニズムの解明に向けた研究が推進されています。しかしながら、未だこれらの研究から得られた知見を基盤とした薬剤やワクチンの開発には至ってはいません。研究代表者は 自身のこれまでの研究を生かし、二種類の薬剤開発を行います。
研究代表者らは、近年、高速AFM を用いてインフルエンザウイルスが宿主細胞に接触する際の、インフルエンザタンパク質のナノスケールにおける構造変化を初めて明らかにしました(Lim et al., BBA, 2020, Lim et al., Nano Letters, 2020)。通常、薬剤開発のためのタンパク質構造解析にはX線回析やクライオEMなどが使われますが、高速AFMはこれらとは異なり、対象を固定せず活性を保ったままナノスケールかつミリ秒単位でその構造変化を観察できます。そこで、研究代表者はSARS-CoV-2および宿主タンパク質の接触について高速AFMを用いて構造解析を行い、その接触を妨げる薬剤を創出します。
すべての細胞応答をつかさどる核の表面には、核膜孔が存在し、核内外の物質輸送を担っています。研究代表者はこの核膜孔を構成するタンパク質(=Nups)が、細胞分裂やオートファジー、がんの発症といった細胞内の生理的活動に重要であることを発表してきました。Nupsのいくつかが、SARS-CoV-2を構成するタンパク質の結合ターゲットとなっていることが報告され(Gordon et al., Nature, 2020)、そのうち、当研究室も先行実験 により、SARS-CoV-2構成タンパク質がNupsと結合していることを明らかにしました(Kobayashi et al., 未発表データ)。このタンパク質は、宿主が持つウイルス増殖抑制効果や免疫作用を弱めることが報告されています。研究代表者は、このタンパク質がNupsに結合し、免疫応答に必要なタンパク質の核内移行を阻止している可能性に着目し、Nups発現を制御できる既存薬剤の中から宿主の免疫正常化につながる薬剤を見出します。
これら二つの薬剤により、SARS-CoV-2の初期感染を阻止し、たとえ感染してしまってもウイルスが引き起こす免疫反応の異常を正常化し、感染患者の早期病状回復につなげたいと考えています。
想定される研究成果
本研究を遂行し、1)SARS-CoV-2の感染第一段階に関わる新規薬剤を創出し、SARSCoV-2および宿主タンパク質との相互作用とその生理学的機能のナノ構造動態を明らかにし、2)SARS-CoV-2 タンパク質と相互作用する核膜孔タンパク質の発現を制御する既存薬剤が、宿主の免疫反応を正常化することを見出します。これらの研究結果は論文発表および特許を取得する予定です。